orimabs技术领域
抗原制备
抗体库
抗体发现
| 抗体工程
抗体生产
抗体应用
|
为了产生抗体,一步是制备重组抗原蛋白。我们拥有用于重组蛋白表达的三个表达平台,包括哺乳动物细胞(CHO和HEK293无血清系统),酵母和大肠杆菌表达系统。
对于人类抗原,哺乳动物表达系统是理想的表达系统,因为其重折叠和翻译后修饰(例如糖基化)接近天然抗原。在大多数情况下,细胞表面抗原的细胞外结构域(例如肿瘤标志物)是抗体生成的目标域。需要制备细胞外结构域的重组蛋白,而不是完整的表面蛋白(包括单个或多个跨膜和细胞内结构域)。然而,部分地由于其天然易位方式的改变而仅表达天然蛋白的一部分是非常具有挑战性的。为了克服这个问题,我们开发了几种新颖的哺乳动物表达载体,它们能够使这种困难表达蛋白高水平表达。
有时为了确保用于文库筛选的抗原处于其天然构象,我们使用抗原阴性和阳性细胞系来筛选文库。我们有一个慢病毒表达系统来创建抗原高表达细胞系。抗原的高表达与细胞内EGFP的表达有关,因此可以通过荧光激活细胞分选术(FACS)纯化高表达的细胞。
酵母展示是一种用于抗体发现的新开发技术。与噬菌体展示相比,酵母展示具有以下优势:真核表达,利用FACS分选来选择性分离不同亲和水平群体的能力以及方便地通过FACS检测抗原结合,这使得酵母展示成为发现新抗体的有力工具。
然而,很大程度上由于酵母转化效率低而构建大的酵母展示抗体文库是非常具有挑战性的。我们开发了一种技术,可使酵母转化效率比传统方法提高1000倍,从而有可能有效地构建大型酵母展示抗体库。
除了优化酵母转化效率外,我们还开发了新颖的酵母展示载体,可以在单体或二聚体中展示scFv,具有*的标签和接头,可有效克隆,展示,检测和保护scFv的结构和功能不受影响由共表达的AGA2蛋白和标签组成(图1)。
如果将分离的scFv的终目标工程化为二聚体,例如scFv-Fv或完整抗体,则建议使用二聚体scFv库,因为高亲和力单体scFv可能不会转化为高亲和力的二聚体。如果scFv是终的抗体形式,例如标记纳米颗粒或开发基于scFv的成像探针,则建议将单体scFv显示库用于scFv分离。有时抗原只有很小的口袋抗原决定簇,这很可能在小肽抗原中观察到,全尺寸的scFv太大而无法适合小的口袋抗原决定簇,一个仅包含VH或VL的单结构域文库将是理想的屏幕。
我们还开发了一种使用重组蛋白,标签融合蛋白或基于细胞的筛选的综合文库筛选策略(图1)。从文库分离的scFv亲和力通常在单体的纳摩尔范围内,并且当被工程化以进行调光时,例如scFv-Fc或完整抗体,亲和力通常将增加约10倍。

插图1:酵母显示的二聚体和单体scFv。
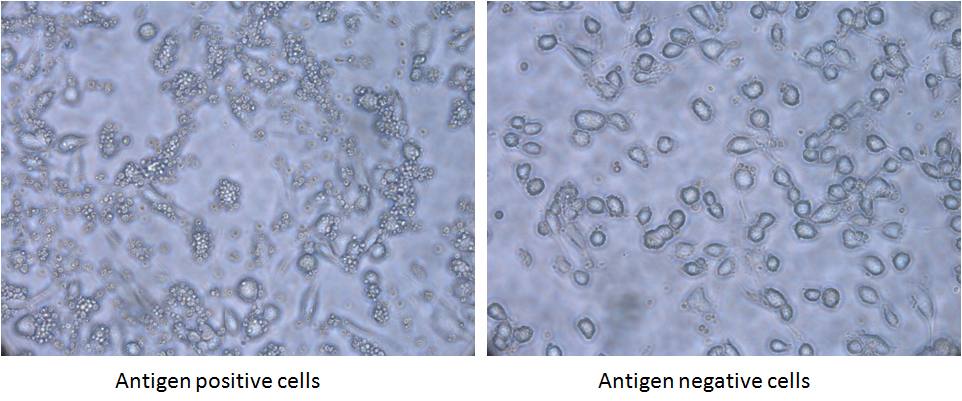
图1:基于细胞的酵母展示抗体文库淘选。
酵母展示对于Fab文库的构建是具有挑战性的,因为很难以适当的比率同时表达VH和VL / VK两者以使VH和VL / VK之间100%偶联。因此,我们的Fab文库是使用噬菌体展示构建的。OriMAbs已开发出用于Fab库构建的噬菌体展示系统。两组噬菌粒,pDCK1和pDCK1.1;以及pDCL1和pDCL1.1分别设计用于κ和λ链Fab展示。两种载体均具有IgG1 CH1恒定区,并且所有恒定区均已针对大肠杆菌进行了密码子优化。表达和所有酶被设计为方便消化和有效克隆。噬菌粒pDCK1和pDCL1也可以用于scFv展示,其中,接头中的酶位点也被优化以确保翻译的接头对于VH和VL之间的有效偶联是灵活的。
使用*的技术和新颖的展示载体pYDS2(展示调节剂scFvs),OriMAbs从B淋巴细胞中分离出了1x1011酵母展示调节剂scFv库,该B淋巴细胞来自于56例健康供体的5升外周血。总共分离出6.9 mg总RNA,并从中纯化了125.3 mg mRNA,并使用能够挽救所有人类抗体库的新型引物用于逆转录和VH,VK和VL扩增。ScFv在酿酒酵母上以较暗的方式显示EBY100通过AGA1和AGA2之间的相互作用使细胞表面应变。在测序的24个克隆中,所有克隆均包含scFv基因,其中83.3%具有单个scFv基因,16.7%具有2个scFv基因。Flag标签在100%克隆中表达,而V5标签在83.3%(20/24)克隆中表达(图2)。V5标签表达失败是由于scFv基因发生移码突变,可能是种系中编码截短抗体或PCR引入的真实序列(3/24)或构象障碍(1/24)。通过磁选和流选与该文库隔离(图3)。建议将该库用于scFv发现,以便将scFv工程化为二聚体,例如scFv-Fc或完整抗体。
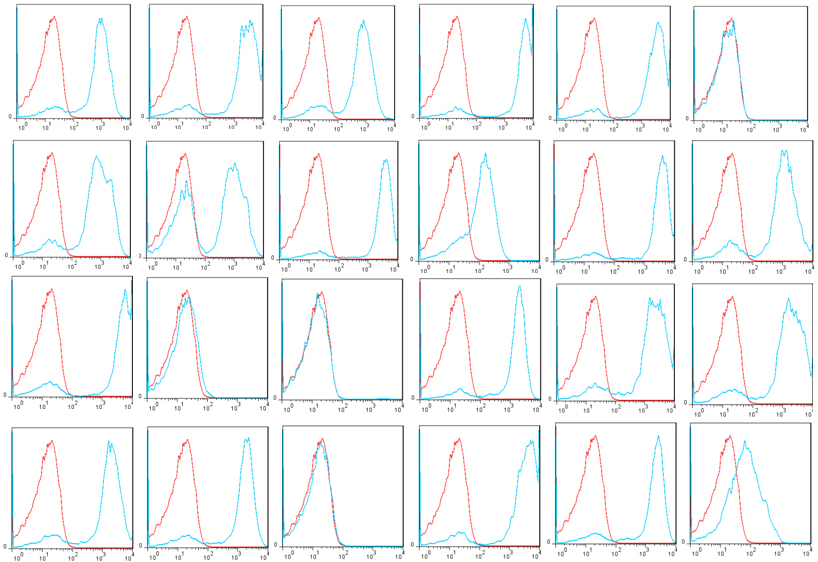
图2:在24个酵母克隆中的V5表达显示了人类天然的scFv文库。红色:阴性对照;蓝色:V5标签表达
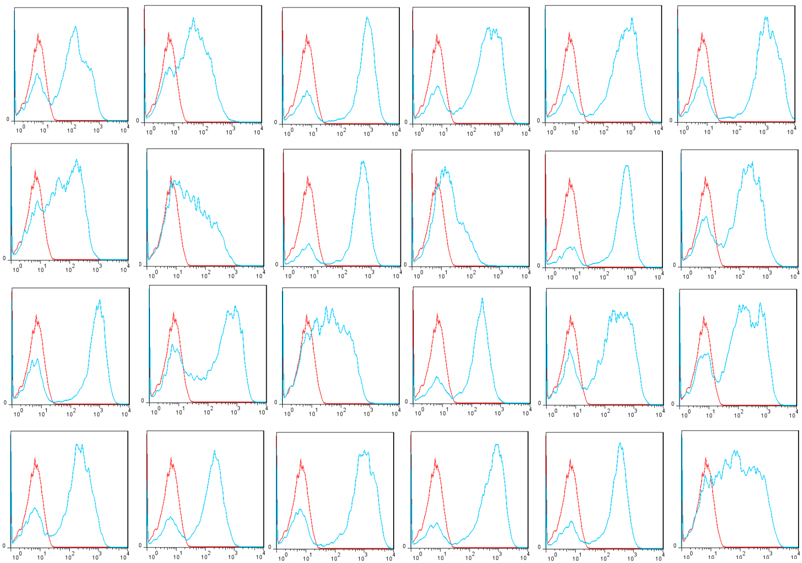
图3:在24个酵母克隆中的标志表达显示了人类天然的scFv文库。红色:阴性对照;蓝色:标志标记表达
还使用不同的酵母展示载体pYDS1和相同的VH,VK和VL基因构建了酵母展示的人类天然单体scFv库,用于二聚体-scFv库的构建。库大小为1.2×10 ^ 11。建议将该库用于scFv发现,因为scFv将是应用程序的终格式。
还使用酵母展示载体pYDS1和相同的VH,VK和VL基因构建了酵母展示人类朴素单域文库,用于单体或二聚体-scFv文库的构建。库大小为5×10 ^ 9。推荐该文库用于发现只有小口袋表位的抗原的单域抗体。
我们使用分离自56个健康供体的相同5 L外周血的VH和VL池,使用载体pDCK和pDCL(kappa:lambda = 2:1)构建了2×1010 Fab噬菌体展示文库。评估的12个克隆显示100%VK / VL插入和91.6%(11/12)VH插入。
我们还开发了一种使用重组蛋白,标签融合蛋白或基于细胞的筛选的综合文库筛选策略(图1)。库平移包括2-3轮磁选,然后是2-3轮精细流选。排序的高亲和力酵母展示群体可直接使用流式细胞仪进行个体克隆鉴定,或转化为分泌型scFv亚库,并使用高通量ELISA进行个体克隆鉴定。鉴定出的scFv将被表达和纯化以用于表征,例如亲和力测量和插入分析,然后进入下游工程流程。从文库中分离出的scFv亲和力在单体中通常处于纳摩尔范围内(图4),通常在经过调光后,亲和力会增加约10倍,

图4:样品scFvs a和b的亲和力测量。
我们已经开发了固相和液相的噬菌体展示文库淘选。直接在固相(例如ELISA板或免疫管)上的抗原包被可能会使抗原构象变形,结果可能丢失一些表位,从而降低分离的抗体的多样性,或者分离的抗体可能根本不结合天然构象抗原。为了克服这个潜在的问题,我们已经开发液相淘选法,其中,无论是抗原和抗体在其天然构象。抗原结合的噬菌体群体将通过磁选分离,分离的可溶性Fab抗体将在大肠杆菌中产生。
从抗体库中分离的单结构域抗体,scFv或Fab抗体通常需要进行工程改造以用于不同的目的,例如,可以将它们改造为scFv-Fc或全抗体,以实现更高的亲和力,更好的稳定性和更长的循环时间。我们提供所有已知格式的抗体的设计和工程改造,例如scFv,二聚体scFv,Fab,F(ab')2,单结构域抗体,scFv-Fc和全抗体。
通常,从我们的文库中分离出的抗体具有纳摩尔范围的亲和力,当工程化为二聚体时,亲和力将增加约10倍。因此,从我们的文库生成的抗体通常不需要亲和力成熟。如果需要更高的亲和力,我们可以选择通过酵母和噬菌体展示技术进行亲和力成熟。
酵母展示的优势在于,可以使用荧光辅助细胞分选术(FACS)轻松对抗原结合的酵母菌群进行分选,因为酵母菌的大小足以被FACS识别。这使酵母菌的展示比噬菌体在亲和力成熟方面更有效,因为除了用于噬菌体展示的抗原浓度管理和严格洗涤之外,FACS在直接将高亲和力酵母种群从其他培养基转化为高亲和力酵母菌方面更有效(图xx) 。

图5:用于抗原结合的高亲和力酵母群体的流式分选。
我们已经开发了用于抗体表达的表达系统,包括用于以细胞内或分泌形式表达单结构域抗体,scFv和Fab的大肠杆菌系统;用于单结构域抗体,scFv和Fab分泌表达的酵母系统; 和用于所有片段抗体和全抗体的分泌表达的哺乳动物系统。我们提供通过这些表达系统生产和纯化所有抗体形式的服务。
抗体药物偶联物(ADC)是一种新兴的抗体治疗技术。抗体(通常是全抗体)通过可裂解或不可裂解的连接子用超毒性药物(例如MMAE,MMAF和DM1)标记,以特异性地向抗原阳性细胞传递毒性。死细胞释放的毒素(MMAE和DM1)也可以通过旁通机制进入并杀死附近的抗原阳性细胞。我们提供与这些药物结合的完整抗体和相关特性的服务。
双特异性抗体(一个臂使用抗CD3抗体靶向T细胞,另一臂使用肿瘤特异性抗体靶向肿瘤细胞)充当将T细胞和肿瘤细胞结合在一起并激活T细胞杀死肿瘤的桥梁。我们提供设计,构建,表达和评估双特异性抗体的服务。
光学成像是一种用于体内抗体生物分布研究的方便且有用的方法,例如小鼠中的抗原表达谱研究,小鼠模型中的肿瘤靶向评估。由于近红外(NIR)染料在组织中的深度渗透(大约1 cm),因此常用于这些研究。我们提供与这些染料和相关表征有效结合和纯化片段抗体或完整抗体的服务。

